
Serialisierung ist und bleibt ganz oben auf der Prioritätenliste
Arzneimittelserialisierung von Asien bis Südamerika
Der Regulierungsprozess für die Serialisierung von Medikamenten ist im Bahrain, Usbekistan und den Vereinigten Arabischen Emiraten abgeschlossen. Weitere Gesundheitsministerien planen nun, wie sie mit Gesetzen zur Arzneimittelserialisierung Verbraucher wirkungsvoll schützen können.
Angesichts des weltweiten Kampfes gegen Arzneimittelfälschungen sind die Anforderungen an die Serialisierung von Medikamenten zu einem wichtigen Bestandteil der Rückverfolgbarkeit und Verifikation geworden. Das ist wichtig und richtig, um Verbraucher und Hersteller wirkungsvoll vor gefälschten Arzneimitteln zu schützen. In Deutschland, Frankreich und den weiteren EU-Staaten kommen entsprechende Lösungen bereits erfolgreich zum Einsatz. Weitere Länder, wie der Bahrain oder Usbekistan, haben in den vergangenen Jahren aufgeholt und die Nachverfolgung sowie Serialisierung verpflichtend eingeführt. Dazu konnten Sie in unserem ersten Blogartikel mehr erfahren. Doch wie sieht es im Rest der Welt aus? – Wir geben Ihnen einen Einblick.
Globale Arzneimittelserialisierung im Schnelldurchlauf
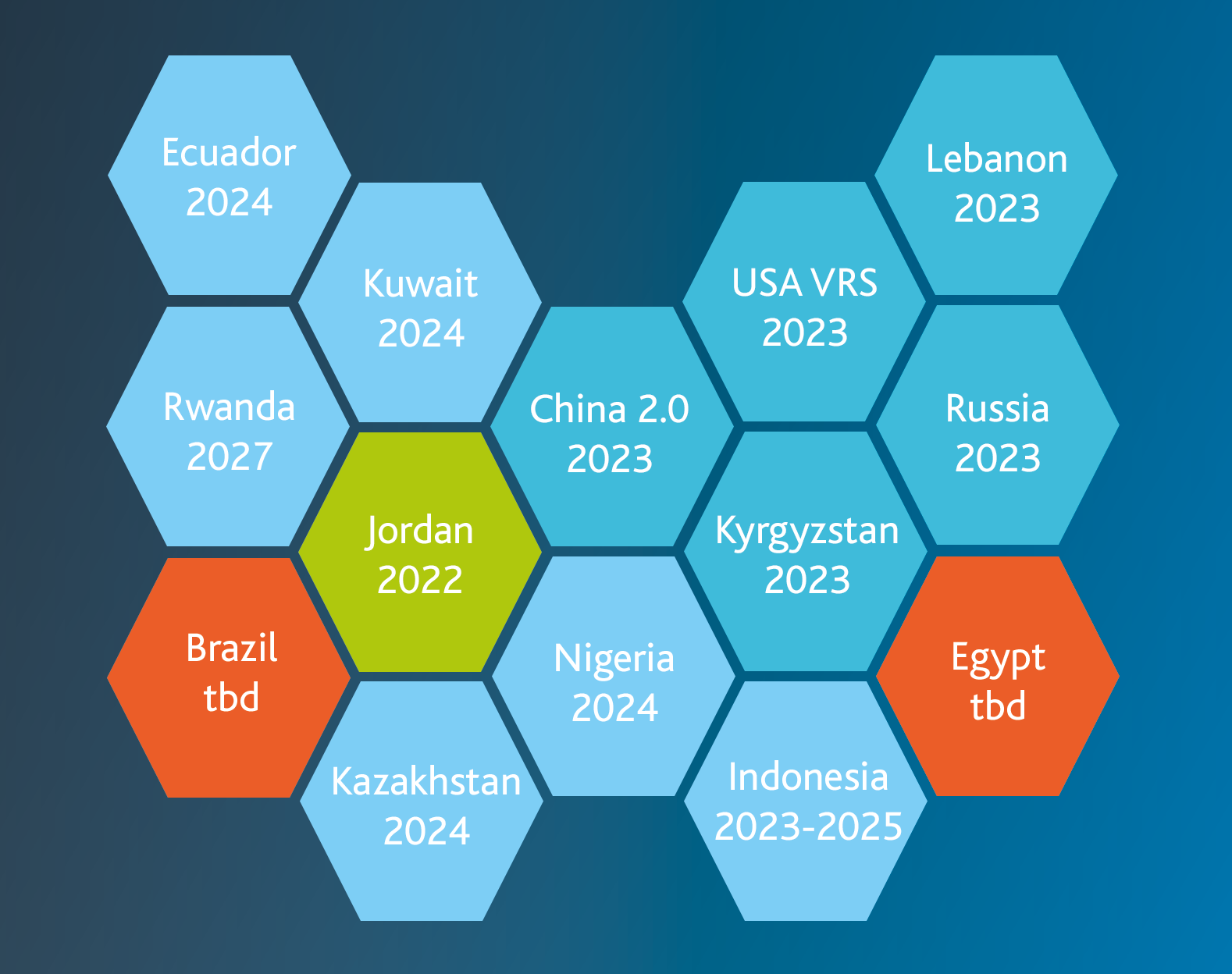
Libanon: Die Deadline für die Arzneimittelserialisierung wurde erst kürzlich erreicht, im Januar 2023. Somit sind die Implementierung und die Anwendung eines Datamatrix-Codes auf allen Verpackungen gesetzlich verpflichtend.
Ägypten: In dem nordafrikanischen Staat begann bereits 2018 das Reporting von Arzneimitteln. Eine neue Entscheidung über eine detaillierte Regelung ist noch nicht erfolgt.
Indonesien: Erst kürzlich wurde eine neue Verordnung veröffentlicht. Es liegen jedoch noch keine weiteren Informationen über einen detaillierten Zeitplan vor.
Ecuador: Die Frist für die Medikamente der „Phase 1“ lief im November 2022 aus. Seither erstreckt sich die Rückverfolgbarkeit in dieser Phase auf 400 Produkte im öffentlichen Gesundheitssystem (RPIS).
Russland: Derzeit wird die API-Version des OMS-Systems 3.0 sowohl auf Demo- als auch auf Produktions-Tracks unterstützt. Die Unterstützung für beide Versionen ist vorläufig bis Ende 2023 geplant, Die Unterstützung der OMS System Version 2.0 läuft voraussichtlich zu diesem Zeitpunkt aus.
Kuwait: In Kuwait wurde die Deadline zur Medikamentenserialisierung und -nachverfolgung auf den Januar 2024 gesetzt. Somit müssen alle lokalen Anforderungen bis Ende 2023 umgesetzt werden.
Ruanda: Für Ruanda ist der Zeitplan noch nicht so eng, wie in vielen anderen Ländern. Die schrittweise Serialisierung und Aggregation sind bis zum Jahr 2027 vorgesehen.
Nigeria: Als Schwellenland ist auch der afrikanische Staat stark von Arzneimittelfälschungen betroffen. Die ebenfalls schrittweise Einführung der Serialisierung soll dem Handel mit gefälschten Medikamenten nun entgegenwirken und bis 2024 umgesetzt sein.
Jordanien: Die Serialisierung wurde in Jordanien bereits eingeführt. Es ist zurzeit nicht geplant, auf eine obligatorische Nachverfolgung umzusteigen. Die jordanische Lebensmittel- und Arzneimittelbehörde hat jedoch ein neues Rundschreiben herausgegeben, in dem die Frist für die Anwendung der Datamatrix-Codes und die Serialisierung auf Sekundärverpackungen von pharmazeutischen Produkten auf den 30. Juni 2023 festgelegt wird.
Kirgisistan: Die lokalen Behörden haben den Erlass des Gesundheitsministers #1110 zur Serialisierung und Rückverfolgbarkeit von Arzneimitteln in Kirgisistan veröffentlicht. Aus dieser geht hervor, dass die freiwillige Einführungswelle im Januar 2023 beginnen wird, die genauen Zeitpläne werden derzeit noch diskutiert. Im Detail sind bereits folgende Punkte regulatorisch festgelegt:
- Wer Nutzer:in des Systems sein möchte, muss über eine gültige kirgisische Lizenz und eine feste Niederlassung vor Ort verfügen
- Die Verantwortung für den Abschluss der Serialisierung liegt beim Importeur
- Kodierungsanforderungen: GS1 Datamatrix einschließlich GTIN + SN + ASCII-Trennzeichen
- Das Verfallsdatum der Charge sowie die Aggregation sind freiwillig
- Produkte, die einen Crypto Code aus anderen Ländern tragen, werden akzeptiert
- Das Produkt muss vor der Zertifizierung serialisiert werden (Aufkleber sind zulässig)
Andere Produkte, die perspektivisch in den Geltungsbereich fallen, sind noch nicht definiert. Eine freiwillige Liste soll von der Arzneimittelbehörde erstellt werden.
China: Bereits am 31. Dezember 2020 lief die Frist bis zur verpflichtenden Rückverfolgbarkeit der wichtigsten Arzneimittel aus. Seither werden in China zwei Kodierungssysteme ausgegeben: Zum einen der GS1-Standard, der eine GTIN als Produktcode verwendet sowie mit einer Datamatrix kodiert ist und zum anderen den AliHealth eCode, der aus einem 20-stelligen- sowie einem Barcode besteht.
Ab 2023 werden neue Standards in Kraft treten, gab die chinesische National Medical Products Administration (NMPA) bekannt. Der genaue Umsetzungszeitplan für sämtliche Produkte ist aktuell noch nicht geklärt. Weitere Änderungen hingegen wurden bereits vereinbart und kommuniziert. Dazu zählen die Anforderungen an die Platzierung und Druckqualität der Codes als auch die Anbringung auf der Verkaufs- und nicht nur auf der Versendereinheit oder Palette. Änderungen in Bezug auf die Informationen, die an das Verifikationssystem gemeldet werden müssen, wird es nicht geben.
USA: Bereits am 27. November 2013 wurde der Drug Quality and Security Act (DQSA) vom Kongress verabschiedet. Titel II des DQSA, das Gesetz zur Sicherheit der Arzneimittelversorgungskette (Drug Supply Chain Security Act, DSCSA), beschreibt die notwendigen Schritte zur Erreichung einer interoperablen und elektronischen Rückverfolgung von Produkten auf Packungsebene. Dadurch sollen bestimmte verschreibungspflichtige Arzneimittel bei ihrer Verteilung in den Vereinigten Staaten zu identifizieren und zurückverfolgt werden können. Ein Teil dieser Anforderungen schreibt gesetzlich vor, dass eine Produktüberprüfung unter bestimmten Umständen notwendig ist. Der schrittweise Ansatz wird am 27. November 2023 in die letzte Phase übergehen. Mit dem näher rückenden Stichtag hat die zunehmende Nutzung und Erfahrung des Verification Routing Service (VRS), die den Lightweight Verification Messaging Standard (LVMS) verwendet, zusätzliche Anforderungen über die verkaufsfähigen Rückgaben hinaus identifiziert. Die pharmazeutische Industrie weitete somit die Nutzung der Verifizierung auf die Untersuchung verdächtiger oder illegitimer Produkte, die Bearbeitung von Ausnahmen und die Statusprüfung aus.
Arvato Systems und die Autorin können nicht für die Richtigkeit der gegebenen Informationen garantieren, da sich Vorschriften und Fristen täglich ändern. In Zweifelsfällen zögern Sie bitte nicht, sich direkt mit dem Team in Verbindung zu setzen.
Verfasst von

Dr. Mareike Elgner ist promovierte Mikrobiologin und als Key Account Managerin bei Arvato Systems tätig. Ihr Fokus liegt auf digitalen Lösungen für die Life-Science-Branche, insbesondere im Bereich Arzneimittel-Serialisierung. Sie begleitet ihre Kunden auch bei Themen wie Cloud und KI.





